摘要:科學家們近日發(fā)現(xiàn)一種名為N4BP2的胞質(zhì)核酸酶驅(qū)動了染色體碎裂。
基因組不穩(wěn)定性,包括染色體碎裂(chromothripsis),是癌癥的標志性特征。盡管染色體碎裂現(xiàn)象在十多年前就已報道,并被認為是癌癥進展的關鍵驅(qū)動力,但其根本原因始終未明。
加州大學圣地亞哥分校的科學家們近日發(fā)現(xiàn),一種名為N4BP2的胞質(zhì)核酸酶驅(qū)動了染色體碎裂。這種酶可侵入破裂的微核并引發(fā)DNA損傷,最終導致染色體片段化。
這項研究成果于12月11日發(fā)表在《Science》雜志上。通過揭示這一過程的啟動機制,研究人員解決了癌癥生物學中一個重要的未解之謎,并為靶向治療侵襲性癌癥開辟了新途徑。
癌細胞依靠多種策略來進化并逃避治療,但染色體碎裂的破壞力極大。與緩慢積累遺傳變異不同,該過程在單次事件中產(chǎn)生數(shù)十處甚至數(shù)百處改變,極大加速了癌癥進化過程。此外,染色體碎裂的發(fā)生率也遠遠高于人們的預期。

圖1 染色體碎裂與染色體外環(huán)狀DNA的形成由N4BP2核酸酶對胞質(zhì)暴露染色體的斷裂所引發(fā)
科學家們估計,大約四分之一的人類癌癥都表現(xiàn)出這種現(xiàn)象,某些癌癥的發(fā)生率甚至更高。幾乎所有骨肉瘤都呈現(xiàn)出染色體碎裂的特征,而該現(xiàn)象在腦腫瘤中的發(fā)生率也明顯升高。
通訊作者、加州大學圣地亞哥分校的Don Cleveland教授表示: “通過追溯染色體斷裂的最初誘因,我們現(xiàn)在有了一個可以有效干預癌癥進展的切入點?!?/div>
圖1 染色體碎裂與染色體外環(huán)狀DNA的形成由N4BP2核酸酶對胞質(zhì)暴露染色體的斷裂所引發(fā)
癌細胞中通常含有微核。一旦微核破裂,其染色體就會暴露出來,容易受到核酸酶的攻擊。不過,研究人員并不知道是哪種核酸酶引發(fā)了染色體碎裂。
為了問答這個問題,研究人員采用了一種基于成像的siRNA篩選技術,對所有已知和預測的204種人類核酸酶進行全面篩查,并實時觀察其對人類癌細胞的影響。他們發(fā)現(xiàn),N4BP2(NEDD4結合蛋白2)具有進入微核并切斷DNA鏈的獨特能力。
為了證明N4BP2確實會引發(fā)染色體碎裂,研究人員隨后在腦癌細胞中敲除了這種酶。他們發(fā)現(xiàn),敲除N4BP2會顯著減少染色體碎裂,而將N4BP2導入細胞核則會導致完整染色體斷裂,即使在原本健康的細胞中也是如此。
第一作者、加州大學圣地亞哥分校的博士后研究員Ksenia Krupina博士指出:“這些實驗表明,N4BP2不僅與染色體碎裂相關,更是其充分誘因。這是首次從分子層面上解釋災難性的染色體斷裂是如何發(fā)生的?!?/div>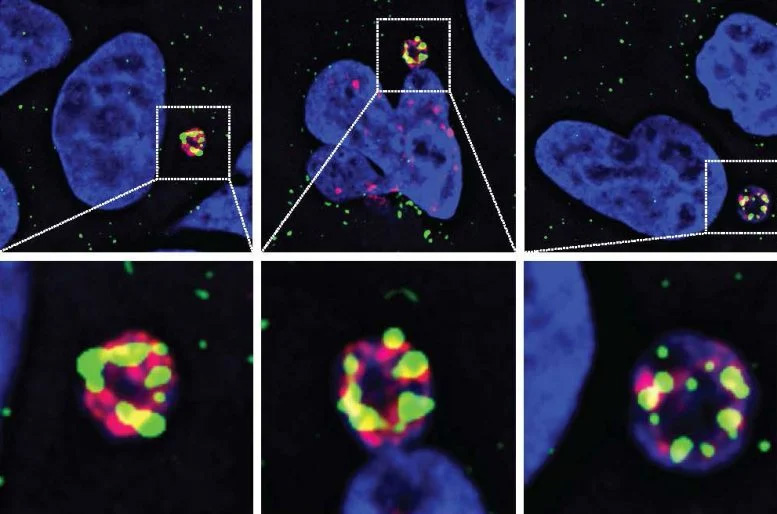
圖2 N4BP2酶(綠色)滲入微核并在其中引發(fā)DNA損傷(紅色)

圖2 N4BP2酶(綠色)滲入微核并在其中引發(fā)DNA損傷(紅色)
研究人員還分析了10,000多個人類癌癥基因組(覆蓋多種癌癥類型),發(fā)現(xiàn)N4BP2高表達的腫瘤表現(xiàn)出明顯更多的染色體碎裂和結構重排現(xiàn)象。同時,這些癌癥還表現(xiàn)出較高水平的染色體外DNA(ecDNA)。
含有ecDNA的腫瘤往往難以治療,因此近年來ecDNA受到了廣泛關注。這項新研究表明,ecDNA并非孤立現(xiàn)象,而是更廣泛存在的染色體碎裂現(xiàn)象的下游結果。
研究將N4BP2定位在這一過程的起始階段,為人們提供了一個新的切入點,有助于了解和控制癌癥中最混亂的基因組不穩(wěn)定性形式。
“了解染色體碎裂的誘因,為我們提供了一種新思路來阻止它。通過靶向N4BP2或其激活的通路,我們或許能夠限制讓腫瘤適應、復發(fā)并耐藥的基因組混亂,” Cleveland教授談道。
參考資料
[1] Repurposing clinically safe drugs for DNA repair pathway choice in CRISPR genome editing and synthetic lethality
摘要:科學家們近日發(fā)現(xiàn)一種名為N4BP2的胞質(zhì)核酸酶驅(qū)動了染色體碎裂。
基因組不穩(wěn)定性,包括染色體碎裂(chromothripsis),是癌癥的標志性特征。盡管染色體碎裂現(xiàn)象在十多年前就已報道,并被認為是癌癥進展的關鍵驅(qū)動力,但其根本原因始終未明。
加州大學圣地亞哥分校的科學家們近日發(fā)現(xiàn),一種名為N4BP2的胞質(zhì)核酸酶驅(qū)動了染色體碎裂。這種酶可侵入破裂的微核并引發(fā)DNA損傷,最終導致染色體片段化。
這項研究成果于12月11日發(fā)表在《Science》雜志上。通過揭示這一過程的啟動機制,研究人員解決了癌癥生物學中一個重要的未解之謎,并為靶向治療侵襲性癌癥開辟了新途徑。
癌細胞依靠多種策略來進化并逃避治療,但染色體碎裂的破壞力極大。與緩慢積累遺傳變異不同,該過程在單次事件中產(chǎn)生數(shù)十處甚至數(shù)百處改變,極大加速了癌癥進化過程。此外,染色體碎裂的發(fā)生率也遠遠高于人們的預期。

圖1 染色體碎裂與染色體外環(huán)狀DNA的形成由N4BP2核酸酶對胞質(zhì)暴露染色體的斷裂所引發(fā)
科學家們估計,大約四分之一的人類癌癥都表現(xiàn)出這種現(xiàn)象,某些癌癥的發(fā)生率甚至更高。幾乎所有骨肉瘤都呈現(xiàn)出染色體碎裂的特征,而該現(xiàn)象在腦腫瘤中的發(fā)生率也明顯升高。
通訊作者、加州大學圣地亞哥分校的Don Cleveland教授表示: “通過追溯染色體斷裂的最初誘因,我們現(xiàn)在有了一個可以有效干預癌癥進展的切入點?!?/div>
癌細胞中通常含有微核。一旦微核破裂,其染色體就會暴露出來,容易受到核酸酶的攻擊。不過,研究人員并不知道是哪種核酸酶引發(fā)了染色體碎裂。
為了問答這個問題,研究人員采用了一種基于成像的siRNA篩選技術,對所有已知和預測的204種人類核酸酶進行全面篩查,并實時觀察其對人類癌細胞的影響。他們發(fā)現(xiàn),N4BP2(NEDD4結合蛋白2)具有進入微核并切斷DNA鏈的獨特能力。
為了證明N4BP2確實會引發(fā)染色體碎裂,研究人員隨后在腦癌細胞中敲除了這種酶。他們發(fā)現(xiàn),敲除N4BP2會顯著減少染色體碎裂,而將N4BP2導入細胞核則會導致完整染色體斷裂,即使在原本健康的細胞中也是如此。
第一作者、加州大學圣地亞哥分校的博士后研究員Ksenia Krupina博士指出:“這些實驗表明,N4BP2不僅與染色體碎裂相關,更是其充分誘因。這是首次從分子層面上解釋災難性的染色體斷裂是如何發(fā)生的?!?/div>
圖2 N4BP2酶(綠色)滲入微核并在其中引發(fā)DNA損傷(紅色)

圖2 N4BP2酶(綠色)滲入微核并在其中引發(fā)DNA損傷(紅色)
研究人員還分析了10,000多個人類癌癥基因組(覆蓋多種癌癥類型),發(fā)現(xiàn)N4BP2高表達的腫瘤表現(xiàn)出明顯更多的染色體碎裂和結構重排現(xiàn)象。同時,這些癌癥還表現(xiàn)出較高水平的染色體外DNA(ecDNA)。
含有ecDNA的腫瘤往往難以治療,因此近年來ecDNA受到了廣泛關注。這項新研究表明,ecDNA并非孤立現(xiàn)象,而是更廣泛存在的染色體碎裂現(xiàn)象的下游結果。
研究將N4BP2定位在這一過程的起始階段,為人們提供了一個新的切入點,有助于了解和控制癌癥中最混亂的基因組不穩(wěn)定性形式。
“了解染色體碎裂的誘因,為我們提供了一種新思路來阻止它。通過靶向N4BP2或其激活的通路,我們或許能夠限制讓腫瘤適應、復發(fā)并耐藥的基因組混亂,” Cleveland教授談道。
參考資料
[1] Repurposing clinically safe drugs for DNA repair pathway choice in CRISPR genome editing and synthetic lethality



